BESSY II zeigt, wie sich Feststoffbatterien zersetzen
Ein Team aus Forschenden von HZB und der Justus-Liebig-Universität Gießen stellen eine neue Methode zur Oberflächencharakterisierung von Batteriematerialien vor
Feststoffbatterien können mehr Energie speichern und sind sicherer als Batterien mit flüssigen Elektrolyten. Allerdings halten sie nicht so lange und ihre Kapazität nimmt mit jedem Ladezyklus ab. Doch das muss nicht so bleiben: Forscherinnen und Forscher sind den Ursachen bereits auf der Spur. In der Fachzeitschrift ACS Energy Letters stellt ein Team des HZB und der Justus-Liebig-Universität Gießen eine neue Methode vor, um elektrochemische Reaktionen während des Betriebs einer Feststoffbatterie mit Photoelektronenspektroskopie an BESSY II genau zu verfolgen. Die Ergebnisse helfen, Batteriematerialien und -design zu verbessern.
Feststoffbatterien verwenden zwischen den Elektroden einen festen Ionenleiter anstelle eines flüssigen Elektrolyten, um den Transport von Lithium zu ermöglichen. Dies hat Vorteile, zum Beispiel eine höhere Sicherheit während des Betriebs und eine höhere Kapazität. Allerdings ist die Lebensdauer von Festkörperbatterien bislang noch sehr begrenzt. Denn an den Grenzflächen zwischen Elektrolyt und Elektrode bilden sich Zersetzungsprodukte und Zwischenphasen, die den Transport der Lithium-Ionen behindern und zu einem Verbrauch von aktivem Lithium führen, so dass die Kapazität der Batterien mit jedem Ladezyklus abnimmt.
Unter welchen Bedingungen finden Reaktionen statt?
Nun hat ein Team um die HZB-Forscher Dr. Elmar Kataev und Prof. Marcus Bär einen neuen Ansatz entwickelt, um die elektrochemischen Reaktionen an der Grenzfläche zwischen Festelektrolyt und Elektrode mit hoher zeitlicher Auflösung zu analysieren. "Unter welchen Bedingungen und bei welcher Spannung finden solche Reaktionen statt, und wie entwickelt sich die chemische Zusammensetzung dieser Zwischenphasen während des Zellbetriebs?" erläutert Kataev die Forschungsfragen.
Der beste Feststoffelektrolyt unter der Lupe
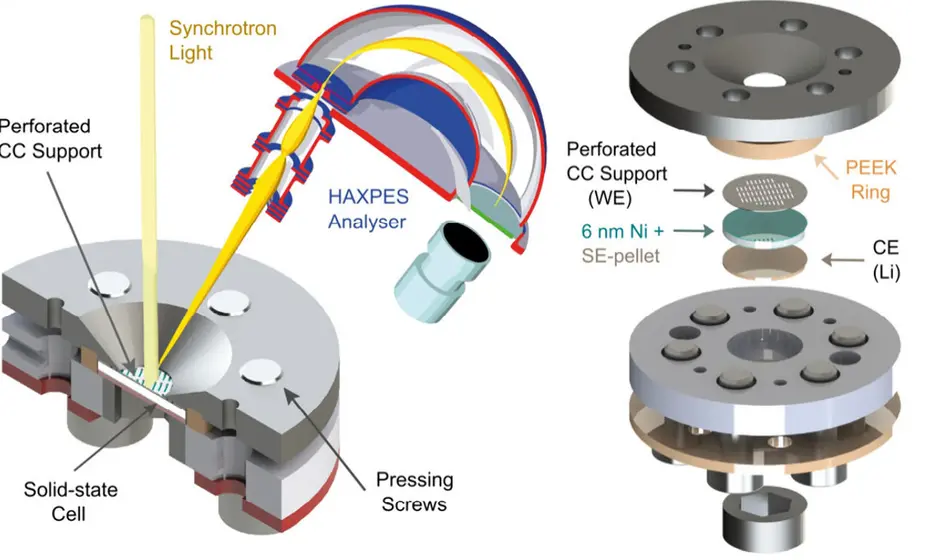
Für die Studie analysierten sie Proben des Festelektrolyten Li6PS5Cl, ein Material, das aufgrund seiner hohen Ionenleitfähigkeit als bester Kandidat für Feststoffbatterien gilt. Dabei arbeiteten sie eng mit dem Team des Batterieexperten Professor Jürgen Janek von der Justus-Liebig-Universität Gießen (JLU Gießen) zusammen. Als Arbeitselektrode diente eine hauchdünne Schicht aus Nickel (30 Atomlagen oder 6 Nanometer). Auf die andere Seite des Li6PS5Cl-Pellets wurde ein Lithiumfilm gepresst, der als Gegenelektrode diente.
Harte Röntgen-Photoelektronenspektroskopie an BESSY II
Um die Grenzflächenreaktionen und die Bildung einer Zwischenschicht (SEI) in Echtzeit und in Abhängigkeit von der angelegten Spannung zu analysieren, nutzte Kataev die Methode der harten Röntgen-Photoelektronenspektroskopie (HAXPES) mit den analytischen Möglichkeiten des Energy Materials In-situ Laboratory Berlin (EMIL) an BESSY II: Röntgenstrahlen treffen dabei auf die Probe, regen die Atome darin an und die emittierten Photoelektronen in Abhängigkeit von der angelegten Zellspannung und der Zeit geben Aufschluss über die Reaktionsprodukte. Die Ergebnisse zeigen, dass die Zersetzungsreaktionen nur teilweise reversibel sind.
Methode auch für andere Batteriematerialien interessant
"Wir zeigen, dass es möglich ist, mit einem ultradünnen Stromkollektor die elektrochemischen Reaktionen an den vergrabenen Grenzflächen mit Methoden der Oberflächencharakterisierung zu untersuchen", sagt Kataev. Das HZB-Team hat bereits Anfragen von Forschergruppen aus dem In- und Ausland erhalten, die ebenfalls an diesem Charakterisierungsansatz interessiert sind. In einem nächsten Schritt will das HZB-Team diesen Ansatz erweitern und auch Batterien mit Polymerelektrolyten und verschiedenen Anoden- und Kathodenmaterialien untersuchen.
ACS Energy Letters (2024): “Operando Photoelectron Spectroscopy Analysis of Li6PS5Cl Electrochemical Decomposition Reactions in Solid-State Batteries”
Burak Aktekin, Elmar Kataev, Luise M. Riegger, Raul Garcia-Diez, Zora Chalkley, Juri Becker, Regan G. Wilks, Anja Henss, Marcus Bär, Jürgen Janek
DOI: 10.1021/acsenergylett.4c01072
Kontakt:
Dr. Elmar Kataev
Helmholtz-Zentrum Berlin für Materialien und Energie
(030) 8062 - 14941
elmar.kataev(at)helmholtz-berlin.de
www.helmholtz-berlin.de
Prof. Dr. Marcus Bär
(030) 8062 - 15641
(030) 8062 - 42678
marcus.baer(at)helmholtz-berlin.de
www.helmholtz-berlin.de
Pressestelle
Dr. Antonia Rötger
(030) 8062 - 43733
antonia.roetger(at)helmholtz-berlin.de
www.helmholtz-berlin.de
Pressemitteilung des HZB vom 09.07.2024.