Klein und effizient
Wasser-Nanotröpfchen kühlen Biomoleküle ultraschnell
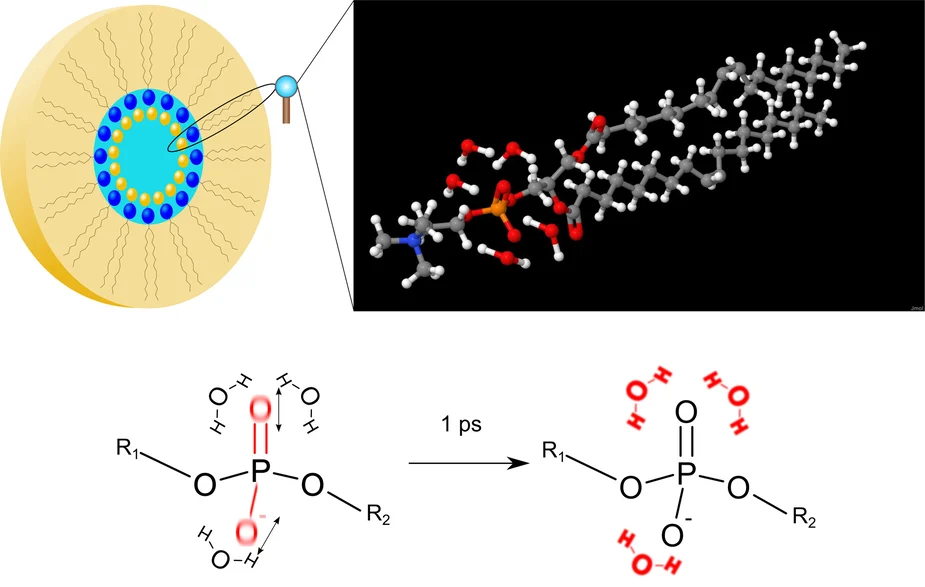
Forscher des Max-Born-Instituts in Berlin haben beobachtet wie Biomoleküle innerhalb von 1 ps thermische Energie in kleinste Wassertropfen in ihrer Umgebung übertragen. Hierfür ist eine aus nur 3 Wassermolekülen bestehende Hülle um ein Phospholipidmolekül ausreichend.
Biochemische Prozesse laufen überwiegend in wässriger Umgebung ab. Dabei werden bestimmte Gruppen eines Biomoleküls in eine Hülle aus Wassermolekülen eingebettet, d.h. hydratisiert. Die Wasserhülle stabilisiert die biomolekulare Struktur und ermöglicht den Energieaustausch zwischen Biomolekül und Umgebung. Beispiele für derartige Systeme sind die DNS-Doppelhelix, der Träger genetischer Information, in wässriger Umgebung, und die aus Phospholipiden bestehende äußere Membran lebender Zellen. Die molekularen Mechanismen, die Geschwindigkeit und Effizienz des Energieaustausches zwischen Biomolekül und Wasserhülle bestimmen, sind erst in Ansätzen verstanden und deshalb Gegenstand aktueller Forschung.
Forscher des Max-Born-Instituts haben jetzt gezeigt, dass kleinste Wasser-"Tröpfchen" in der Umgebung eines Lipidmoleküls einen Energietransfer im Zeitbereich unterhalb 1 ps, d.h. in weniger als 1 Millionstel einer Millionstel Sekunde ermöglichen. Wie René Costard, Christian Greve, Ismael Heisler und Thomas Elsässer in der neuesten Ausgabe der Zeitschrift Journal of Physical Chemistry Letters (Band 3, Seite 3646, 2012) berichten, reichen 3 an die Phosphatgruppe des Lipids gekoppelte Wassermoleküle aus, um Schwingungsenergie aus dem Lipid effizient zu übertragen und in thermische Energie der Wasserhülle zu verwandeln. Dabei wird die Wasserhülle um 10 bis 20 °C erwärmt. Die thermische Energie steckt vorwiegend in Kippbewegungen der Wassermoleküle, sog. Librationen, und führt zu einer Schwächung der Wechselwirkung zwischen den Wassermolekülen, den sog. Wasserstoffbrücken. Die molekulare Struktur der Wasserhülle bleibt auf der Zeitskala der Energieübertragung nahezu unverändert. Dieser extrem effiziente Mechanismus erlaubt auch die Übertragung größerer Energiemengen und kann so das Lipidmolekül vor Beschädigungen seiner Struktur durch Überhitzung schützen.
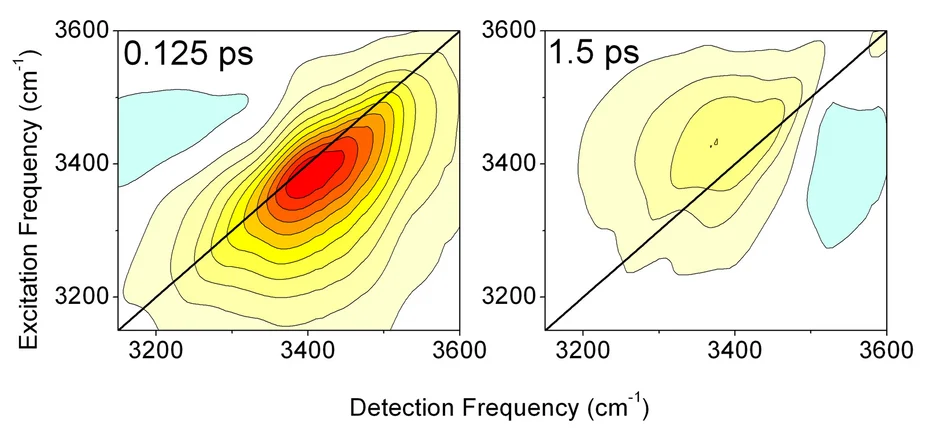
In den Experimenten wurde ein Phospholipid-Modellsystem untersucht, das aus DOPC-Molekülen besteht (Abb.1). Diese Moleküle sind als sog. inverse Mizellen angeordnet, in deren Innern die Phosphatgruppen (PO4) der Lipidmoleküle hydratisiert werden. Dabei lässt sich der Wassergehalt in weiten Grenzen verändern. Zur Untersuchung des Energietransfers wurde mit Lichtimpulsen von ca 0.1 ps Dauer entweder eine Phosphatschwingung des Lipids oder die OH-Streckschwingung von Wassermolekülen angeregt. Beide Schwingungen zerfallen in Bruchteilen einer Pikosekunde und geben die dabei freiwerdende Energie an die Wasserhülle ab. Dieser Übertragungs- und Umverteilungprozess wurde durch Messung transienter zweidimensionaler Schwingungsspektren der OH-Streckschwingung des Wassers verfolgt (Abb. 2). Die Schwächung der Wasserstoffbrücken in der aufgeheizten Wasserhülle führt zu einer Verschiebung der OH-Streckschwingung zu höheren Frequenzen. Aus der zeitabhängigen Veränderung dieser Spektren lässt sich direkt die Dynamik der Energieübertragung ableiten.
Kontakt
René Costard, costard(at)mbi-berlin.de, Tel. 030 6392 1454
Dr. Ismael Heisler, heisler(at)mbi-berlin.de
Prof. Thomas Elsässer, elsasser(at)mbi-berlin.de
Originalpublikation: R. Costard, C. Greve, I. A. Heisler, T. Elsaesser: Ultrafast energy redistribution in local hydration shells of phospholipids: a two-dimensional infrared study. J. Phys. Chem. Lett. 3, 3646 (2012).