Die Wechselwirkung zwischen Ribonukleinsäure und Wasser
MBI-Forscher nutzen Schwingungsspektroskopie zur Analyse biomolekularer Systeme
Ribonukleinsäure (RNA) spielt eine Schlüsselrolle für biochemische Prozesse, die auf zellulärer Ebene in einer wässrigen Umgebung ablaufen. Mechanismen und Dynamik der Wechselwirkung zwischen RNA und Wasser wurden jetzt durch Schwingungsspektroskopie im Ultrakurzzeitbereich aufgeklärt und theoretisch analysiert.
Ribonukleinsäure (RNA) ist ein elementarer Bestandteil biologischer Zellen. Während Desoxyribonukleinsäure (DNA) das Speichermedium der Erbinformation darstellt, verfügt RNA über eine vielfach komplexere biochemische Funktionalität. Dies beinhaltet die Informationsübertragung in Form von mRNA, RNA-vermittelte katalytische Aktivität in Ribosomen, bis hin zur Speicherung von Erbinformation in Viren. Chemisch besteht RNA aus einer Abfolge organischer Nukleobasenmoleküle, die durch ein sog. Rückgrat aus Phosphat- und Zuckergruppen zusammengehalten werden.
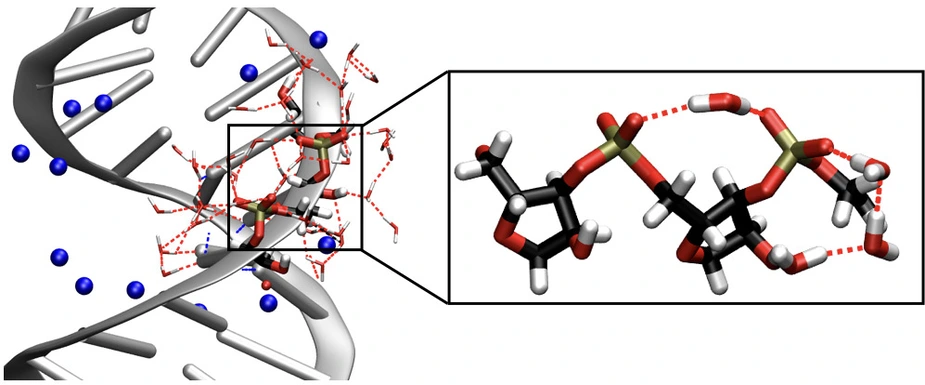
Ein derartiger Molekülstrang kann einzeln oder gepaart in Form einer Doppelhelix vorliegen. Beide makromolekularen Formen sind in eine Wasserhülle eingebettet, die Sauerstoffatome der Phosphat- und Zuckergruppen stellen ausgezeichnete Kontaktstellen für Wassermoleküle dar. Die Struktur der Wasserhülle weist hierbei Fluktuationen in einem Zeitbereich von Bruchteilen einer Pikosekunde (1 ps = 10-12 s = 1 Millionstel einer Millionstel Sekunde) auf. Die Wechselwirkung zwischen RNA und Wasser und ihre Rolle für die Ausbildung dreidimensionaler RNA-Strukturen sind erst in Ansätzen verstanden und experimentell schwer zugänglich.
Forscher am Max-Born-Institut haben jetzt mit einer neuen experimentellen Methode die Wechselwirkung zwischen RNA und der umgebenden Wasserhülle in Echtzeit verfolgt. Dabei dienen Schwingungen des RNA-Rückgrats als empfindliche Sonden für den Einfluss der unmittelbar benachbarten Wassermoleküle auf Struktur und Dynamik der RNA. Mit der sog. zweidimensionalen Schwingungsspektroskopie lassen sich die zeitliche Entwicklung von Schwingungsanregungen aufzeichnen und molekulare Wechselwirkungen innerhalb der RNA wie auch zwischen RNA und Wasser bestimmen. Dabei zeigt sich, dass Wassermoleküle an der RNA-Oberfläche ultraschnelle Kippbewegungen in Bruchteilen einer Pikosekunde ausführen, ihre lokale räumliche Anordnung jedoch für einen Zeitraum von mehr als 10 Pikosekunden beibehalten. Dieses Verhalten weicht von der Dynamik des reinen Wassers deutlich ab und ist stark durch die räumlichen Randbedingungen an der RNA-Oberfläche beeinflusst. Einzelne Wassermoleküle verbinden hierbei benachbarte Phosphatgruppen und bilden eine teilweise geordnete Struktur, die durch Kopplung an die Zuckereinheiten vermittelt wird.
Die sich bewegenden Wassermoleküle erzeugen eine elektrische Kraft, mit der die Wasserfluktuationen auf Schwingungen der RNA übertragen werden. Die Schwingungen des RNA-Rückgrats zeigen ein unterschiedliches dynamisches Verhalten, das von der lokalen Wasserumgebung bestimmt wird und deren Heterogenität widerspiegelt. RNA-Schwingungen koppeln ihrerseits aneinander, sie tauschen Energie untereinander und mit der Wasserhülle aus. Die damit verbundene ultraschnelle Umverteilung von Überschussenergie verhindert ein lokales Überhitzen der makromolekularen Struktur. Dieses komplexe Szenario wurde durch detaillierte theoretische Berechnungen und Simulationen analysiert, mit denen u.a. die Schwingungsbewegungen des RNA-Rückgrats erstmals komplett und quantitativ identifiziert wurden. Vergleichende Experimente an DNA enthüllen Gemeinsamkeiten aber auch charakteristische Unterschiede im Verhalten dieser beiden elementaren Biomoleküle, wobei sich RNA durch eine strukturiertere Anordnung der umgebenden Wasserhülle auszeichnet.
Die Ergebnisse der Studie demonstrieren das vielfältige Potential von nicht-invasiver zeitaufgelöster Schwingungsspektroskopie, um das Wechselspiel von Struktur und Dynamik auf molekularen Längen- und Zeitskalen in komplexen biomolekularen Systemen zu entschlüsseln.
Originalartikel:
E. M. Bruening, J. Schauss, T. Siebert, B. P. Fingerhut, T. Elsaesser: Vibrational Dynamics and Couplings of the Hydrated RNA Backbone: A Two-Dimensional Infrared Study.
J. Phys. Chem. Lett. 9, 583-587 (2018). DOI: 10.1021/acs.jpclett.7b03314.
Kontakt:
Max-Born-Institut für Nichtlineare Optik und Kurzzeitspektroskopie (MBI)
im Forschungsverbund Berlin e.V.
Dr. Benjamin Fingerhut
Tel.: 030 6392-1404
E-Mail: fingerhut(at)mbi-berlin.de
Prof. Dr. Thomas Elsaesser
Tel.: 030 6392-1400
E-Mail: elsasser(at)mbi-berlin.de