Käfigstruktur verwandelt sich in effizienten Katalysator zur Erzeugung von grünem Wasserstoff
Vielversprechende Materialklasse der Clathrate wurde an BESSY II untersucht
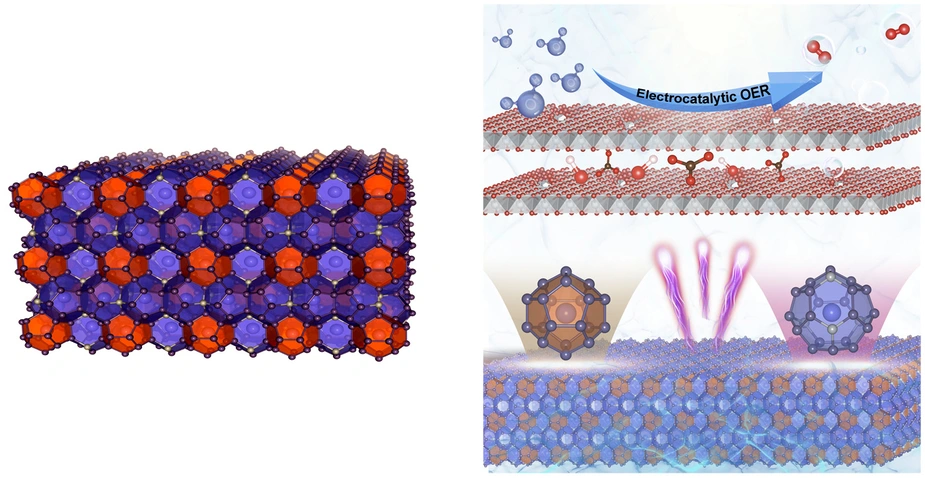
Clathrate zeichnen sich durch eine komplexe Käfigstruktur aus, die auch Platz für Gast-Ionen bietet. Nun hat ein Team erstmals untersucht, wie gut sich Clathrate als Katalysatoren für die elektrolytische Wasserstoffproduktion eignen. Das Ergebnis: Effizienz und Robustheit sind sogar besser als bei den aktuell genutzten Nickel-basierten Katalysatoren. Dafür fanden sie auch eine Begründung. Messungen an BESSY II zeigten, dass sich die Proben während der katalytischen Reaktion strukturell verändern: Aus der dreidimensionalen Käfigstruktur bilden sich ultradünne Nanoblätter, die maximalen Kontakt zu aktiven Katalysezentren ermöglichen. Die Studie ist in „Angewandte Chemie“ publiziert.
Wasserstoff kann durch die elektrolytische Aufspaltung von Wasser gewonnen werden. Sofern die dafür benötigte elektrische Energie aus erneuerbaren Energiequellen stammt, ist dieser Wasserstoff sogar klimaneutral. Dieser „grüne“ Wasserstoff gilt als wichtiger Baustein für das Energiesystem der Zukunft und wird auch als Rohstoff für die Chemische Industrie in großen Mengen benötigt. Bei der Elektrolyse sind zwei Reaktionen entscheidend: die Wasserstoffentwicklung an der Kathode und die Sauerstoffentwicklung an der Anode (OER). Vor allem die Sauerstoffentwicklungsreaktion bremst jedoch den gewünschten Prozess. Damit die Wasserstoffproduktion weiter Fahrt aufnehmen kann, müssen noch effizientere, robuste Katalysatoren für den OER-Prozess entwickelt werden.
Clathrate mit Käfigstruktur
Aktuell gelten Nickel-Verbindungen als gute und günstige Katalysatoren für die alkalische Sauerstoffentwicklungsreaktion. Hier setzt das Team um Dr. Prashant Menezes an. „Für die Effizienz eines Katalysators spielt der Kontakt zwischen aktiven Nickel-Zentren und Elektrolyt eine wesentliche Rolle“, sagt der Chemiker. „Bei herkömmlichen Nickel-Verbindungen ist diese Oberfläche begrenzt. Wir wollten daher testen, ob sich Nickelhaltige Proben aus der faszinierenden Materialklasse der Clathrate als Katalysatoren eignen.“
Die Proben bestanden aus Ba₈Ni₆Ge₄₀ und wurden an der TU München hergestellt. Wie alle Clathrate zeichnen sie sich durch eine komplexe kristalline Struktur aus polyedrischen Käfigen aus, hier aus Germanium und Nickel, die ein weiteres Element (hier Barium) einschließen. Aufgrund dieser speziellen Struktur besitzen Clathrate besondere Eigenschaften, die sie als Thermoelektrika, Supraleiter oder Batterie-Elektroden interessant machen. Bisher kam jedoch noch keine Gruppe auf die Idee, Clathrate als Elektrokatalysatoren zu untersuchen.
Experimente an BESSY II, FU und TU Berlin
Die elektrochemischen Messungen zeigten, dass der Ba₈Ni₆Ge₄₀ als Katalysator die Effizienz von Nickeloxid-Katalysatoren übertrifft und das bei einer Stromdichte von 550 mA cm⁻², die auch für die industrielle Elektrolyse genutzt wird. Auch die Stabilität war bemerkenswert hoch: Selbst nach 10 Tagen im Dauerbetrieb ließ die Aktivität nicht nennenswert nach.
Warum sich das Material so erstaunlich gut eignet, konnte das Team durch eine Kombination von Experimenten herausfinden. An BESSY II untersuchten sie die Proben mit in situ Röntgenabsorptionsspektroskopie (XAS), während Strukturcharakterisierungen an der Freien Universität Berlin und der Technischen Universität Berlin stattfanden.
Hochporöser “Schwamm” aus Nickelverbindungen
Ihre Analyse zeigte, dass die Ba₈Ni₆Ge₄₀-Partikel im wässrigen Elektrolyten unter einem elektrischen Feld eine strukturelle Umwandlung durchmachen: Aus dem vormals dreidimensionalen Gerüst lösen sich Germanium-Atome und Barium-Atome heraus. „Die Germanium- und Barium-Atome machen fast 90 Prozent des anfänglichen Materials aus und werden komplett ausgewaschen, zurück bleiben hochporöse, schwammartige Nanoschichten aus den verbleibenden 10 Prozent Nickel, die eine maximale Oberfläche bieten“, sagt Dr. Niklas Hausmann aus dem Team um Menezes. Diese Umwandlung bringt immer mehr katalytisch aktive Nickel-Zentren in Kontakt mit dem Elektrolyten.
„Wir waren tatsächlich überrascht, wie gut diese Proben als OER-Katalysatoren arbeiten. Wir gehen davon aus, dass wir solche Ergebnisse auch an anderen Übergangsmetall-Clathraten beobachten können und dass wir mit den Clathraten eine sehr interessante Materialklasse für Elektrokatalysatoren entdeckt haben“, sagt Menezes.
Publikation:
Angewandte Chemie (2025): Ba-Ni-Ge Clathrate Transformation Maximizes Active Site Utilization of Nickel for Enhanced Oxygen Evolution Performance
Ziliang Chen, Hongyuan Yang, J. Niklas Hausmann, Stefan Mebs, Viktor Hlukhyy, Holger Dau, Matthias Driess, Prashanth W. Menezes
DOI: 10.1002/anie.202424743
Kontakt:
Helmholtz-Zentrum Berlin für Materialien und Energie
Abteilung Materialchemie für Katalyse
Jan Niklas Hausmann
+49 30 8062-12957
niklas.hausmann(at)helmholtz-berlin.de
Dr. Prashanth Menezes
+49 30 8062-14630
prashanth.menezes(at)helmholtz-berlin.de
Dr. Antonia Rötger
Pressestelle
+49 30 8062-43733
antonia.roetger(at)helmholtz-berlin.de
Pressemitteilung HZB vom 17.04.2025